— Bedriftene og forskere kan ikke komme tidlig nok
Interessen for Legemiddelverkets rådgivningstjeneste overfor bedrifter og akademia har vokst kraftig de siste årene. Med nye midler over statsbudsjettet for å etablere innovasjonskontor, ønsker de å gjøre tjenesten mer proaktiv overfor de som trenger den.

— Hele spekteret av bedrifter og akademia innen legemiddelutvikling og klinisk utprøving tar kontakt med oss for veiledning. Vi har mange små bedrifter, og vi har en del mellomstore. Vi har faktisk også noen Big Pharma-bedrifter som ber om assistanse, men det er færre av dem. Og de det gjelder er ofte innen legemidler til fisk. På veterinærsiden, inkludert fiskemedisin, finnes det et stort behov. Men også akademia og forespørsler knyttet opp mot kliniske studier får vi en del av, forteller Sayeh Ahrabi, seksjonssjef ved Farmasøytisk seksjon ved Avdeling for legemiddelutredning i Legemiddelverket.
Flere bruker tjenesten
Hun forteller ivrig om hvem som benytter seg av Legemiddelverkets veiledningstjeneste for legemiddelfirma og akademia, som det i år er blitt foreslått bevilget to millioner kroner over statsbudsjettet til. I 2014 skrev NFT om at veiledningstjenesten var så smått satt i gang, og siden sist tidsskriftet snakket med Ahrabi har legemiddelmyndigheten jevnt over fått økt antallet henvendelser.
— Vi har tall fra 2015 som viser at vi hadde 32 rådgivningsmøter det året. Da snakker vi om formelle møter her på huset med mange utredere til stede, der vi har fått spørsmål på forhånd og har fått forberedt oss. Det er fordelt på 13 møter for legemidler til dyr og 19 for legemidler til mennesker. I 2014 hadde vi 24 slike møter, så vi ser en klar økning. Vi har også andre typer henvendelser der jeg for eksempel blir kontaktet og setter vedkommende over til riktig person, og vedkommende får svar der og da. De henvendelsene teller vi imidlertid ikke med, opplyser Ahrabi.
Ifølge seksjonssjefen kommer veiledningskompetansen fra lang erfaring med utredning av nye legemidler i europeiske nettverk for godkjenning av legemidler og utredning på europeisk skala.
— Der kommer vår styrke, kunnskap og kompetanse fra, som vi ønsker å bruke videre på de som har kommet til et visst punkt i utviklingen av et nytt legemiddel, og lurer på hva de skal gjøre nå.
Passiv form
Hun forteller at rådgivningstjenesten til nå har vært passiv fra Legemiddelverkets side.
— Det er firmaene som tar kontakt med oss via en e-postadresse, og vi henviser også til denne adressen dersom de ringer oss. Den som da har ansvar for denne e-posten videreformidler forespørselen til relevante personer i resten av organisasjonen. Deretter koordinerer vi hjelpen ut fra hvilket område firmaet eller personer fra akademia ønsker hjelp med. Ofte organiseres et møte. Foreløpig er det ingen egne personer i Legemiddelverket som er dedikerte til å håndtere og koordinere denne tjenesten, og oppgavene gjøres på rundgang.
— Hva slags type henvendelser kan dere få fra de som jobber innen akademia?
— Det typiske fra den kanten er at det skal gjøres en klinisk studie. Vi er den myndigheten som godkjenner kliniske studier med legemidler, og når vi mottar søknaden fra en del klinikere i akademiske miljø på universitetene, ser vi ofte at kvaliteten på søknadene er for dårlig. I disse tilfellene går vi selv ut og sier at søknaden ikke holder mål i forhold til internasjonale standarder, og tilbyr således veiledningsmøte, forklarer Jan Petter Akselsen, som er avdelingsdirektør i Avdeling for legemiddelutredning i Legemiddelverket.
Ifølge ham går de fleste feilene de finner på såkalt Good Clinical Practice (GCP).
— Det går på at man følger internasjonale kvalitetsstandarder som er laget for å ivareta pasienten og sikre vitenskapelig kvalitet. Pasientsikkerhet er et selvstendig godt poeng, det har noe å gjøre med den tillit pasienten som sier ja til å delta i en klinisk studie viser forskeren. De skal kunne være sikre på at opplegget er ordentlig. På den annen side vil vi jo også gjerne at norske offentlige forskningsmidler brukes godt, slik at det ikke vil være behov for å gjenta en studie på grunn av dårlig design eller mangel på kontroll over viktige faktorer.
Akselsen legger til at det fra mindre forskningsmiljøer for eksempel kan ønskes råd om utviklingsprogram og enkeltprotokoller.
— De er ofte så tidlig ute at vi snakker om preklinikk og om hvilke dyrearter man må teste produktet på. Det kan også gå helt ned til for eksempel hva vi synes om en kontrakt med en lab som skal gjøre toksikologiske studier for dem. Ser opplegget greit ut? Vi får også forespørsler om utviklingen og produksjonsaspekter av selve legemiddelet.
— Legge kortene riktig i starten
Ifølge Akselsen kan man i noen av de prosjektene som kommer fra akademia se et produktutviklingsløp litt lenger frem i tid.
— Da er det viktig at kortene legges riktig i starten. Det er en ambisjon fra akademisk miljø om å utvikle noe som faktisk skal bli et produkt til pasientbehandling. Det trenger ikke å være så voldsomt innovativt heller, men poenget er at de har ambisjoner om å komme på markedet med et produkt. Og da må de sørge for å gjøre ting slik at det faktisk blir godkjennbart.
— Vårt bidrag er at de designer studiene på en riktig måte, slik at de får et ja eller nei-svar som de faktisk kan stole på. Svaret skal være tolkbart, for man kan ha veldig mange ulike faktorer i en studie. Og hvis man ikke har god kontroll, kan man ikke vite helt hva man har fått ut av en studie. Ved at svaret er tolkbart første gang man gjennomfører studien, sparer man både seg selv og samfunnet for tid og kostnader. Det er vi veldig opptatte av, skyter Ahrabi inn.
— Kan dere gå nærmere inn på hvilke problemstillinger firmaene kommer til dere med?
— De små firmaene kan ikke komme til oss tidlig nok. De bør komme veldig tidlig i prosessen, og ofte venter nok noen litt for lenge. Vi får spørsmål om mye forskjellig. Trenger vi validering av denne metoden i denne fasen? Hvilke retningslinjer gjelder for mitt produkt? Hva er nok for å komme oss til neste fase? Er den kliniske studien riktig tenkt i forhold til målet for studien og det vi ønsker å vise? Har vi tenkt riktig endepunkt? Mange sånne type spørsmål som er veldig fornuftige, for da kan vi gi tilbakemelding på det vi tror er best, forklarer seksjonssjefen.
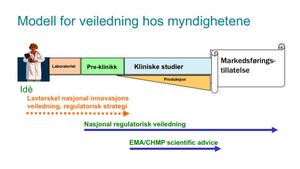
Avdelingsdirektøren trekker frem en grafisk fremstilling av løpet et legemiddel må gjennom før det kan bli gitt markedsføringstillatelse (MT). (Se figur 1.)
— Denne viser løpet helt fra tidlig idéfase til nasjonalt arbeid og europeisk godkjenningsarbeid når man nærmer seg MT. Kommer man seg til fase III, er det viktig å få råd (scientific advice) fra det europeiske legemiddelkontoret European Medicines Agency (EMA), som kan kalles den europeiske utgaven av legemiddelrådgivningen Legemiddelverket i dag tilbyr. Men prosedyren for scientific advice hos EMA er komplisert, formell, krever mye forberedelse og koster mye penger. Så vi ser for oss dette som et «continuum» fra et nasjonalt lavterskeltilbud som vår veiledningstjeneste.
Diskuterer finansiering
Foreløpig er tilbudet gratis for de som ønsker å benytte seg av det, men Legemiddelverket ser for tiden på muligheter for finansieringen av en slik tjeneste.
— Men vi kan ikke bare bestemme at vi skal ha en betalingsmodell, det må forankres hos overordnet myndighet. For andre tjenester vi tilbyr er det avgifter og gebyrer som er hjemlet, og det har vi ikke på plass for denne tjenesten ennå, sier Akselsen.
— Er det vanlig at firmaene har kontakt med dere gjennom store deler av prosessen frem til eventuell MT?
— Tjenesten er fortsatt såpass fersk at vi foreløpig ikke har hatt noen inne som har kommet helt til MT ennå. Men selv de som kommer til oss med litt skepsis om hva vi kan tilby, spesielt fra akademia, vender ofte tilbake til oss, og er fornøyde med tjenesten vi tilbyr. Jeg tror mange er positivt overrasket, sier Ahrabi.
Positive resultater
Ettersom Norge er et lite land i legemiddelsammenheng, er det ifølge Akselsen vanskelig å komme opp med gode data for suksessraten for firmaene som benytter seg av en slik tjeneste. Det har derimot EMA klart. De har i en undersøkelse sett på suksessraten for firmaene som benyttet seg av EMAs Scientific Advice. Suksessraten ble målt på hvilke firmaer som oppnådde MT i etterkant av veiledning, og resultatene er ifølge Ahrabi oppsiktsvekkende.
— I undersøkelsen så man blant annet på forskjellene mellom firmaene som kom tidlig til rådgivning og de som kom sent. De som kom tidlig hadde 78 prosent suksessrate, og de som kom sent hadde 64 prosent suksessrate. Men kanskje mer interessant var statistikken over de som etterlevde rådene de fikk fra Scientific Advice. De som fulgte rådene hadde 84 prosent suksessrate, og hos de som ikke fulgte rådene var det 43 prosent suksessrate. Det er halvert suksessrate for de som ikke fulgte tipsene, og det viser en klar og tydelig effekt for en slik rådgivningstjeneste, konstaterer seksjonssjefen.
Akselsen påpeker at også norske legemiddelmyndigheter bidrar i europeisk sammenheng.
— De som er utredere ved Statens legemiddelverk deltar også i EMAs sentrale Scientific Advice. Så dette må ses i sammenheng.
Bakgrunnen for undersøkelsen som ble gjennomført i 2014, og som førte til at veiledningstjenesten til Legemiddelverket ble opprettet, var blant annet en masteroppgave Ahrabi skrev. I den sammenliknet hun legemiddelmyndighetene i Sverige og Norge.
— I forhold til veiledning så jeg at vi i Norge var veldig passive, og i enkelte tilfeller også avvisende overfor bedrifter som ønsket råd. Dette gjaldt spesielt hvis type produkt eller bruksområdet var ukjent for Legemiddelverket fra før. Så oppgaven kom med en sterk anbefaling om at det er vinn-vinn for næringen i Norge og for Legemiddelverket, ettersom en tjeneste som dette gir også oss en sterk kompetanse på problemløsning, som igjen kan brukes i utredningssammenheng og rådgivning til andre firmaer.
Masteroppgaven ga ideen til å gjennomføre en undersøkelse i det norske miljøet, både hos sykehusene og i innovative bedrifter, i tillegg til å snakke med Legemiddelindustrien (LMI).
— Og vi fikk en sterk anbefaling om at dette var en tjeneste som var veldig ønsket. Helt uformelt startet vi opp tjenesten sakte, men sikkert i 2013 uten tilførsel av nye ressurser, og vi har snart holdt på i tre år.
Ifølge Akselsen er det ikke unikt å ha nasjonal veiledning og rådgivning for aktørene i denne bransjen.
— Det henger sammen med organisasjonens kompetanse og selvtillit. Vi kom jo ikke i gang med å delta i det europeiske godkjenningssystemet før litt etter år 2000, da vi ble deltakende gjennom EØS-avtalen. Vi brukte noen år på å bygge opp en portefølje med utredningssaker og kompetanse blant de ansatte. Så fremover på 2000-tallet og frem til 2013 da det ble bestemt at vi skulle begynne med dette, var det en holdning i organisasjonen om at dette var litt for stort og vanskelig for oss. Nå har andelen oppgaver vi har tatt på oss på vegne av de europeiske legemiddelmyndighetene økt betydelig siden 2005, påpeker han.
— Kunnskapen vi sitter på kan også brukes i tjenesteyting for å gi noe tilbake til samfunnet. Det har vi jobbet mye med, og den forståelsen føler jeg nå er gjennomgående i alle avdelingene i Legemiddelverket, legger Ahrabi til.
Ønsker å være proaktive
I forslag til statsbudsjett for 2017 foreslås det nå to millioner kroner i rammebevilgning til å etablere innovasjonskontor ved Legemiddelverket. Ifølge seksjonssjefen går veiledningstjenesten nå fra å være et prosjekt til drift. Man ønsker å bruke midlene til å ha én dedikert ansatt som vil jobbe med dette på Legemiddelverkets innovasjonskontor.
— Det vil si å ta imot og videreformidle henvendelser, eventuelt svare på de selv. Denne personen vil da også koordinere rådgivningsmøtene vi skal ha og finne riktig kompetanse til disse. Vi tenker også at denne funksjonen skal være mer oppsøkende, både gjennom å delta og holde innlegg i møter som arrangeres av andre, i tillegg til å organisere egne møter. Rett og slett vise hvor fornuftig det er å benytte seg av denne tjenesten. For det vi vet er at det er mange som ikke er klar over at denne tjenesten eksisterer og hva den kan bidra med. Så vi tror antallet henvendelser vil øke dersom tjenesten blir mer kjent.
Avdelingsdirektøren gjør det klart at to millioner kroner ikke er mye i denne sammenhengen, men at symbolverdien er vel så viktig.
— Vi har fått et signal om aksept for videre fokus på dette området. Å få penger over statsbudsjettet viser at vi har gått fra en fase der vi kunne tilby veiledning dersom det var tid og folk hadde lyst til å jobbe med det, til at vi nå får beskjed om at også politisk ledelse synes dette er viktig. Og dette henger klart sammen med ny legemiddelmelding der «legge til rette for forskning og innovasjon» er en av fire søyler i ny legemiddelpolitikk.
Akselsen mener det er mye god forskning som skjer i Norge, men at fokuset som oftest alltid ligger på selve forskningen og finansieringen av denne, samt patentbeskyttelse av produktet.
— Det vi ønsker å hjelpe med, er at de også klarer å ha en god regulatorisk strategi. Det vil øke sjansene for å få til en markedsføringstillatelse i andre enden.
Feil metodebruk kan nemlig sette kroken på døra for prosjekter som burde ha gode muligheter for å lykkes.
— Men hvis du anvender feil metode og gjør metodologiske feil, så hjelper det ikke hvordan dataene blir, da rammes du av det. Hvis du bommer på det første forsøket ditt, mister kanskje investorene interessen. Så det er om å gjøre å komme over denne delen på skjemaet vårt som vi kaller dødens dal (fra den prekliniske fase til klinisk fase). Og ved å følge tipsene vi gir reduserer man rett og slett sjansen for å gjøre feil, understreker han.
Samarbeid med NorCRIN
Legemiddelverket vil i fortsettelsen av denne tjenesten ha en naturlig samarbeidspartner i Norwegian Clinical Research Infrastructures Network (NorCRIN), som er det norske kontaktleddet til European Clinical Research Infrastructure Network (ECRIN).
— De arbeider med å legge til rette for å gjøre det lettere å gjennomføre kliniske studier i Norge. Dette gjøres blant annet gjennom å forsikre seg om at klinikkene har kvalitetssystemer, fokus og dedikasjon til å gjøre kliniske studier. NorCRIN fikk bevilgninger fra Forskningsrådet for to år siden, og de vil være en nær samarbeidspartner for oss og vår rådgivningstjeneste. De sitter ikke på vår godkjenningskompetanse, men de skal være gode på hvordan man skal gjennomføre en studie når protokollene er ferdige og skal gjennomføres praktisk. Det dreier seg om infrastruktur og å knytte klinikkene sammen.
Det regulatoriske området er i konstant endring, og Akselsen mener det er viktig for mindre legemiddelfirmaer i Norge å ha en regulatorisk strategi.
— I Europa har det nå kommet nye tiltak på det regulatoriske området for å få god innovasjon raskere ut til pasientene. I og med at vi er en del av Europa, deltar vi også i disse nye prosedyrene, blant annet PRIME (priority medicines). Det betyr at regulatoriske myndigheter er mye tidligere ute med å gi råd til firmaene. Grunnlaget for initiativet i Europa skal være at pasienter skal få raskere tilgang til ny behandling. Slike nye tiltak er det bare vi som kan føre ut til norske utviklingsmiljøer, konstaterer Akselsen.
(Publisert i NFT nr. 11/2016 side 11-13)
